

力学所在生物大分子凝聚体涌现力学特性研究中取得进展
蛋白质和RNA等生物大分子通过多价弱相互作用发生相分离,形成具有动态特性的液态聚集体。这些凝聚体能够在细胞内对多种生命活动进行精确的时空调控,其进一步发生的力学变化是阿尔兹海默症等神经退行性疾病的致病机制。然而,以往研究多集中于由单组分或简单多组分生物大分子形成凝聚体的生化特性,其力学行为通常符合经典麦克斯韦流体模型。真实细胞环境中的生物相分离凝聚体常由多价蛋白质通过复杂相互作用形成动态网络,其力学特性可能远超现有模型的描述范围。如何解析这类复杂液态凝聚体的力学行为及其分子机制,成为领域内的重要挑战。近日,力学研究所关东石研究员与香港科技大学童彭尔教授及南方科技大学张明杰院士等联合团队,利用原子力显微镜(AFM)介观流变学与定量荧光测量技术,首次系统解析了由6种突触后蛋白(6xPSD)重构的功能性凝聚体的涌现力学特性,揭示了其动态交联网络的力学松弛规律及生理意义。相关成果以“Emergent mechanics of a networked multivalent protein condensate”为题发表于《Nature Communications》。
研究团队通过构建由6种突触后蛋白组成的凝聚体,首次揭示了多组分和多价蛋白质凝聚体中超越传统简单组分凝聚体(如PGL-3,单一指数松弛)的力学特性。通过AFM力学弛豫和压痕实验,研究团队发现多价功能蛋白质凝聚体具有独特的双模式力学松弛机制——由蛋白扩散主导的短时指数衰减和由网络动态重构主导的长时幂律衰减(图1)。进一步的荧光漂白恢复(FRAP)、荧光定量(FIQ)和离心实验表明,凝聚体中80%的蛋白质可自由扩散,而剩余20%的支架蛋白可形成动态交联网络(图2)。这一网络通过最弱键(如PSD-95与GKAP的结合,解离常数Kd =176 μM)的解离动力学调控幂律松弛,揭示了生物凝聚体力学行为的分子基础。动态网络赋予凝聚体类似“软玻璃态”的力学特性,既能通过自由扩散蛋白快速响应机械刺激,又能通过缓慢的网络重组维持结构稳定性,为突触可塑性提供了可能的力学解释(图3)。 该研究不仅为解析复杂液态生物凝聚体的力学特性建立了实验与理论框架,还为相关疾病机制研究提供了新思路。
该工作得到国家自然科学基金、中国科学院重点部署项目、中国科学院战略性先导科技专项等资助。
论文链接:https://doi.org/10.1038/s41467-025-60345-9
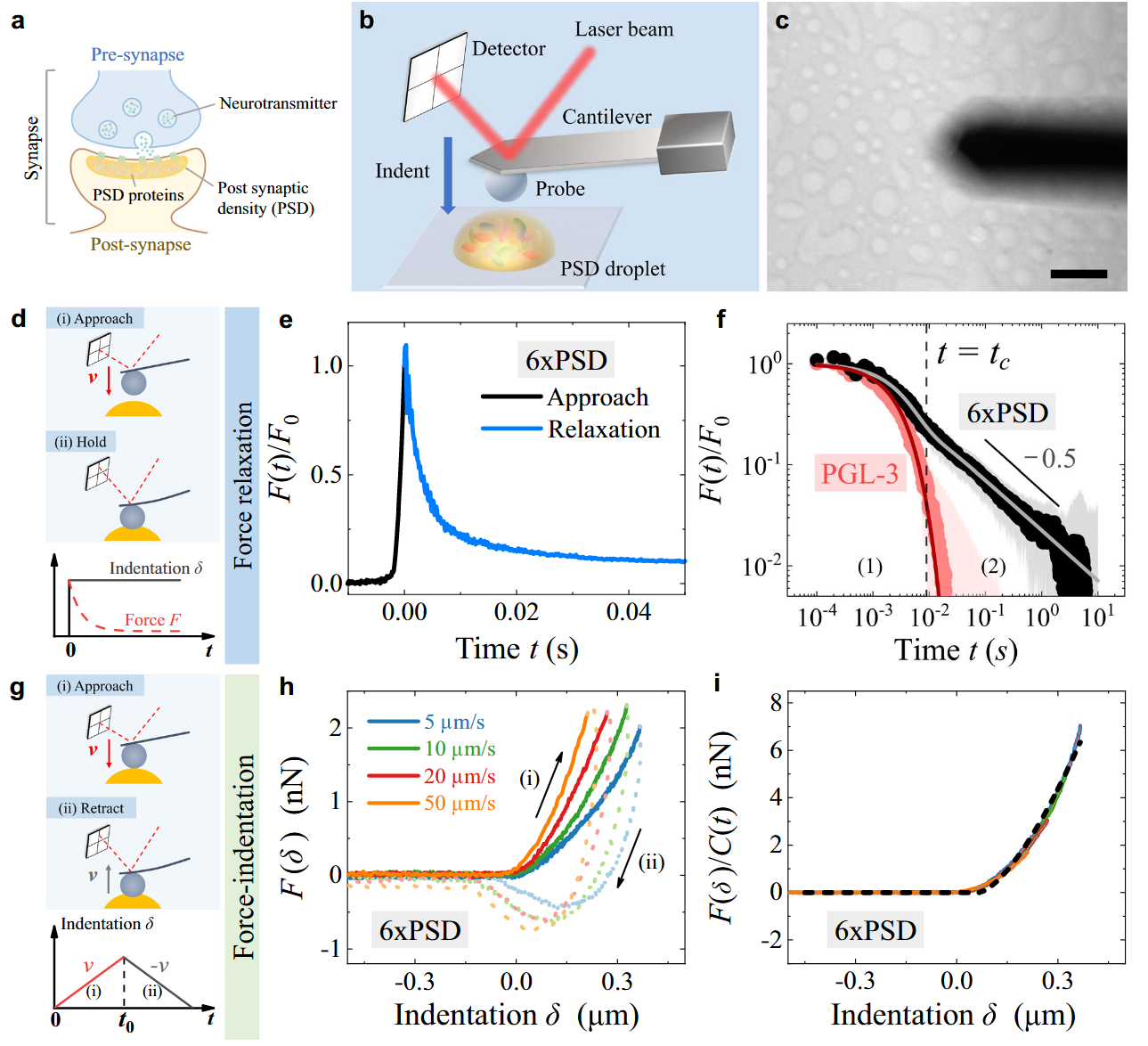
图1:AFM力学弛豫和压痕实验揭示6xPSD的双模式力学松弛机制
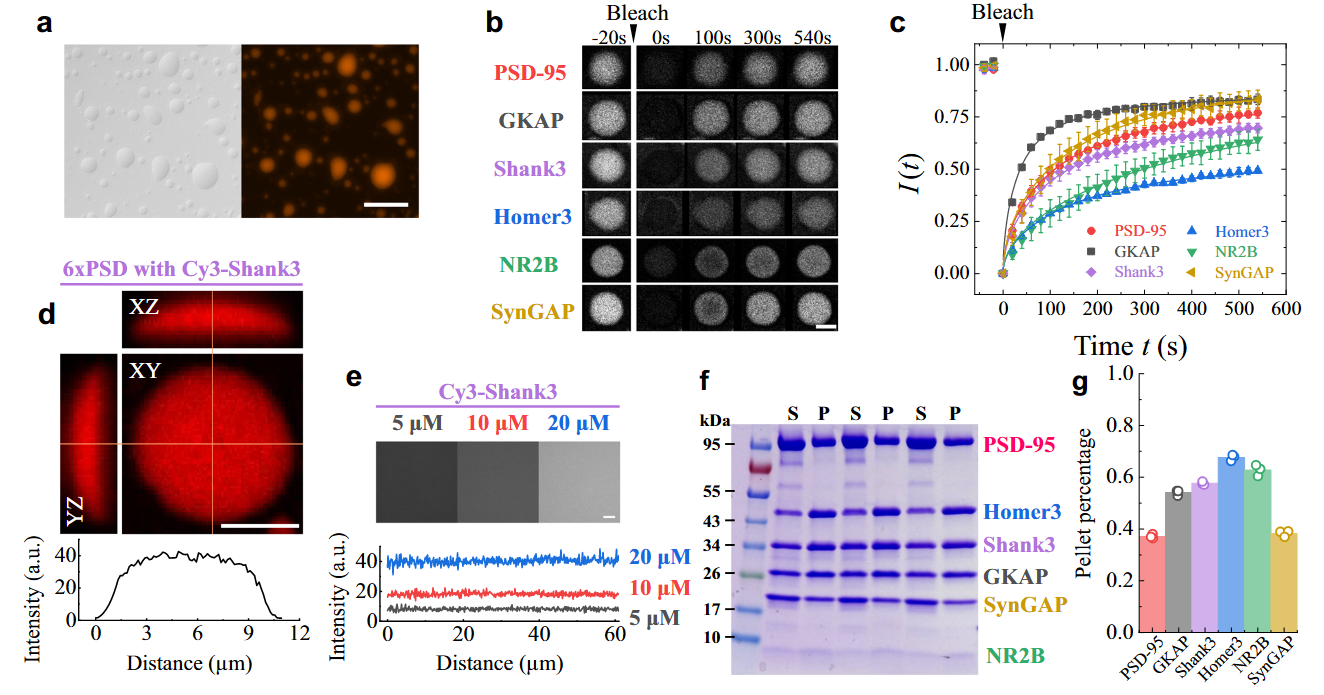
图2:荧光定量和离心实验揭示6xPSD蛋白扩散和浓度分布规律
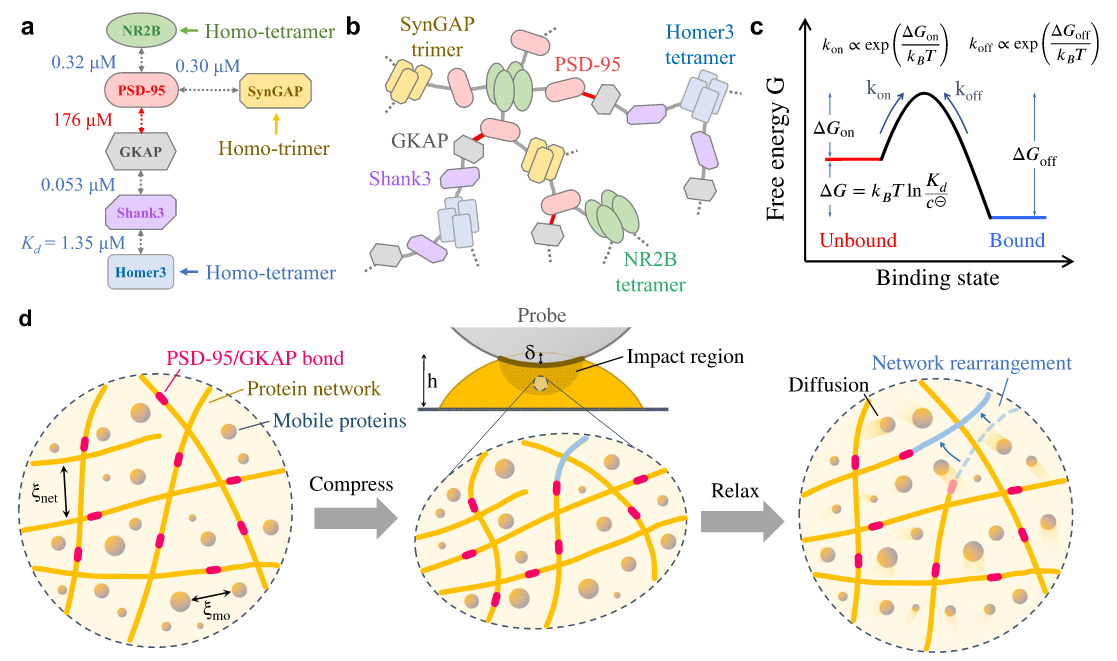
图3:6xPSD的蛋白相互作用、网络构建和双模式弛豫示意
附件下载: