

力学所在双特异性抗体研发方面取得进展
在肿瘤治疗领域,抗体药物偶联物(ADC)凭借其独特的作用机制,成为极具潜力的治疗手段。其中,上皮细胞黏附分子(EpCAM)作为一种肿瘤抗原,在众多上皮癌中呈现高度表达状态,这使其成为开发ADC的理想靶点之一。然而,EpCAM ADC的临床推进之路却充满坎坷,主要难题在于它们会对胃肠道、肾脏和胰等正常高表达EpCAM的组织产生毒性反应,严重制约了其临床应用与发展。因此,探寻新的靶点组合或开发新型ADC策略,对于提高肿瘤治疗的有效性和安全性具有重要意义。力学所超常环境非线性力学全国重点实验室研究团队联合北京大学第三医院、北京航空航天大学等,以EpCAM和CLDN3为研究对象,开发了一种可适用于多种实体肿瘤的双特异性抗体药物偶联物。
本研究通过分子结构创新,设计出可同时识别EpCAM和CLDN3的双特异性BsADC。该药物通过双重靶点协同作用,既能精准攻击肿瘤细胞,又能避免对EpCAM高表达的正常组织(如肝脏、肠道)产生毒性,显著提升了治疗安全性。研究发现在33种人类癌症类型中,CLDN3的表达模式与EpCAM密切相似。传统的单靶点抗体药物在治疗实体瘤时,常因其靶点在正常组织中也具有较高表达而引发“脱靶毒性”,从而限制了临床应用。相比之下,CLDN3 在正常细胞中几乎不表达,而在多种肿瘤细胞中呈高表达的特性,使其成为理想的治疗靶点。基于这一优势,本研究选择 CLDN3 作为开发靶点,并与 EpCAM 结合,设计并构建了双特异性抗体偶联药物(BsADC),用于多种实体瘤的靶向治疗。
该工作以“Development of a bispecific antibody-drug conjugate targeting EpCAM and CLDN3 for the treatment of multiple solid tumors”为题发表在《Experimental Hematology & Oncology》上。力学所特别研究助理罗美英为论文第一作者。该研究工作得到国家自然科学基金、中国科学院战略性先导科技专项(B类)、中国科学院青年创新促进会、中国博士后科学基金等项目资助。
原文链接:https://doi.org/10.1186/s40164-025-00624-9
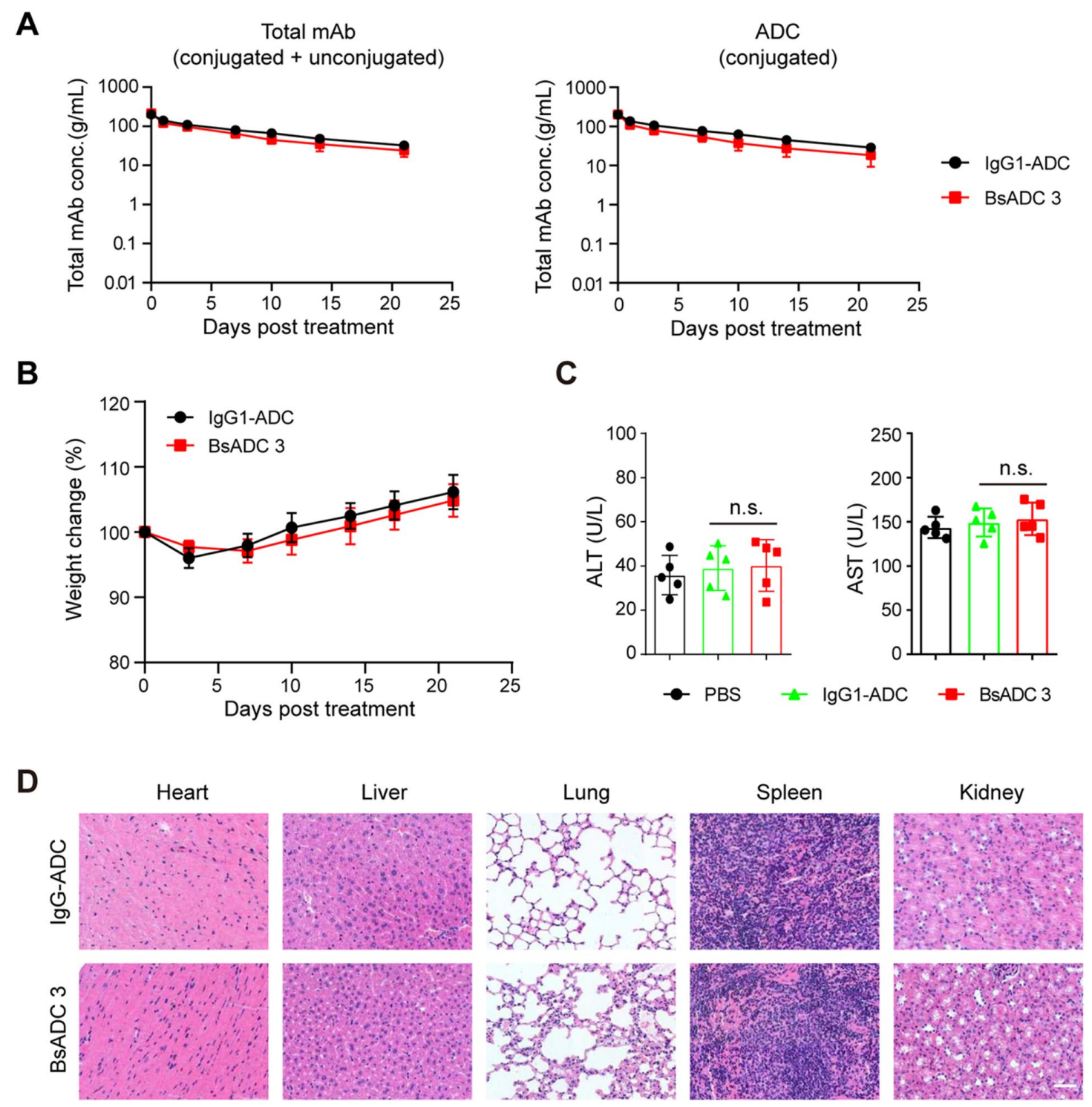
图1 EpCAM×CLDN3双特异性抗体药物偶联物的体内药代动力学及安全性研究
附件下载: