

波动力与癌细胞粘附性能的关联
细胞是生命的基本结构与功能单元。为 保持相对独立性,细胞由外层细胞膜包裹。 作为分隔细胞内、外不同介质和组成成分的 界面,细胞膜主要由磷脂双分子重复排列而 成,即磷脂双分子层,上面镶嵌有各种类型 的蛋白质、糖类和胆固醇等(图 1) 。此外, 细胞膜通过膜蛋白与细胞骨架相连,以维持 细胞基本形态。具有生物学功能的细胞膜其 基本功能是维持细胞本身结构的完整性,保 护细胞内部的组成成分,为细胞的生命活动 提供相对稳定的内微环境;同时,细胞膜是 细胞与细胞、细胞与周围环境之间进行信息 传递和物质交换的通道。
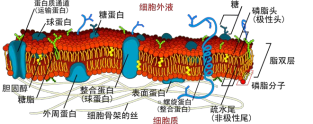
图 1 细胞膜的结构模型(图片来自于网络 https:// en.wikipedia.org/wiki/cell_membrane)
研究表明,大量与细胞膜密切相关的细 胞进程,如细胞粘附、细胞融合、膜间结合 与解离的转变、细胞膜自组装,在生物体的
生命活动中发挥了非常重要的作用。例如, 病毒感染、细胞迁移依赖于细胞粘附过程; 囊泡运输以及精子、卵子间的受精过程则与 细胞融合息息相关。上述现象本质上是细胞 膜间相互作用力调控的结果。因此,对细胞 膜间的相互作用力及其作用规律的研究显得 尤为重要。
由于细胞膜结构的多样性,使得细胞膜 间相互作用异常复杂(图 2) 。大量研究结 果表明,细胞膜间的相互作用力既包括吸引 力,也包括排斥力。其中,细胞膜波动引起 的相互作用力包括:波动力、蠕动力、突出 力与头基重叠力。相比于四种空间位阻力中 的其他作用力,波动力的显著特征在于它的 作用范围最长,属于长程力,并且其大小可 与范德华力相匹敌(图 3) 。正因为如此, 波动力得到了更广泛的关注与研究。通常情 况下,细胞膜易发生弯曲。在室温条件下弹 性弯曲消耗的能量很低,它们如同风中的旗 帜一样波动、涨落。如图 4 所示,单片膜可 以自由地波动,然而,当两个膜相互彼此靠 近时,它们会相互阻碍对方的涨落、降低系 统的熵,使细胞膜系统的自由能趋于增加, 从而产生了排斥波动力以保持细胞膜间的平 均距离。
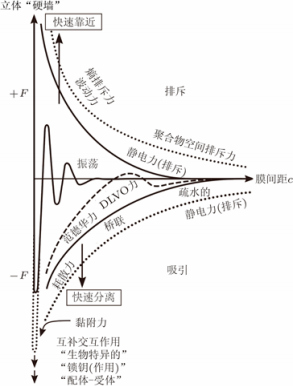
图 2 细胞膜间的相互作用势[1]
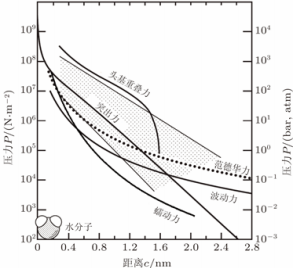
图 3 生理条件下,膜间相互作用力的理论计算值[1]
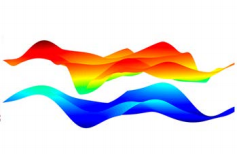
图 4 细胞膜的波动示意图[2]
在生理环境下,波动力主要通过影响膜 间配体、受体间的相互作用实现对癌细胞粘 附以及癌细胞转移的调控。受体与配体蛋白 的粘附强度可由二者的亲和力 K2D 表征:K2D 越大表明受体 - 配体键和能力越强,细胞的 整体粘附性能越好。早期研究中,研究人员 针对均值膜系统进行了深入研究工作 [3] 。在 均质膜系统中, 细胞膜上仅含有粘附蛋白质。 研究结果显示,由于上、下双层细胞膜的热 扰动会引起排斥波动力, 因此会给膜间配体、 受体的键和带来不利的影响。定量分析显示, 在这种均值膜系统中 K2D 与波动力成反比关 系(图 5)。
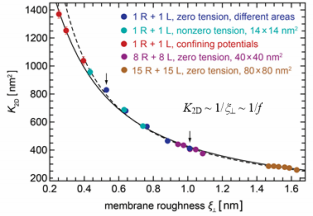
图 5 均值膜粘附系统中 K2D 与膜间相对粗糙度及波动力的关系[3]
然而,实验表明细胞膜并非均质体, 而是含有许多富含鞘磷脂与胆固醇的微结构 域。这些具有特定功能的微区被称为“脂筏”。 脂筏凭借自身结构与功能的独特性,在信号 传导、物质输运等细胞进程中扮演着核心角 色,并且与神经类疾病(如阿尔茨海默病、 帕金森病) 、朊病毒疾病、心血管疾病、免 疫紊乱(如全身性红斑狼疮) 、HIV 感染等 疾病的发生、发展密切相关, 因而备受关注。 相比于均质膜系统,波动力在这种含有脂筏 的多组分膜系统中对膜间配体、受体相互作 用的影响亟待研究。我们课题组针对该问题 进行了深入系统的研究。如图 6 所示,对于 含有脂筏的多组分膜粘附系统,K2D 与波动 力的关系由均值膜系统中的反比关系变为了 正比关系。即引入脂筏后,波动力促进了受 体 - 配体键和。这与均质膜粘附系统的情况 是截然相反的。其本质原因在于,在波动力 的作用下,脂筏内的蛋白质聚集引起的细胞 膜构象熵增加,从而揭示了波动力与脂筏在 膜间受体- 配体相互作用过程中的协同效应。 同时,我们发现由于波动力会使得受体 - 配 体结合体间产生吸引作用。借助粘附蛋白与 脂筏间的亲和性,波动力可以促进脂筏聚集相变与粘附蛋白聚集。通过影响脂筏与蛋白 质的分布,波动力会进而影响膜间受体 - 配 体键和作用[5]。
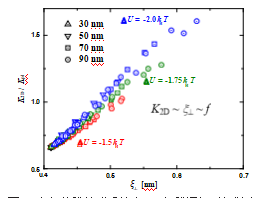
图 6 多组分膜粘附系统中 K2D 与膜间相对粗糙度及波动力的关系[4]
上述相关研究进一步揭示了由细胞膜热 扰动引起的波动力在癌细胞粘附过程中对受 体 - 配体键和的影响。相关工作对于揭示癌 症转移机理、辅助药物研发具有重要的意义。
参考文献
1. J. N. Israelachvili. Intermolecular and Surface Forces,Waltham: Academic Press. 2011.
2. P. Sharma . Entropic force between membranes reexamined, Proc. Natl. Acad. Sci.USA, 110, 1976- 1977, 2013.
3. J. Hu, R. Lipowsky, T. R. Weikl, Binding constants of membrane-anchored receptors and ligands depend strongly on the nanoscale roughness of membranes, Proc. Natl. Acad. Sci.USA, 110, 15283- 15288, 2013.
4. L. Li, J. Hu, X. Shi, Y.F. Shao, F. Song,Soft Matter, 13, 4294-4304, 2017.
5. L. Li, J Hu, B. Ro?z?ycki, F. Song, NanoLetter., 20, 722-728, 2020.
李龙,现任中国科学院 力学研究所非线性力学国家 重点实验室助理研究员。于 2018 年获中国科学院力学研 究所博士学位, 并工作至今。 主要研究方向包括细胞力学 与眼生物力学。
附件下载: