

力学所在胚胎早期发育中力学振荡操控细胞分化研究中取得进展
在哺乳动物胚胎早期发育中,细胞命运决定是关乎胚胎发育调控机制及组织/器官模式形成的重要课题。其中,在第一次细胞命运决定(即滋养外胚层TE与内细胞团ICM分化)完成后,会发生第二次细胞命运决定,即囊胚腔内细胞团ICM中的上皮细胞(EPI)和原始内胚层细胞(PrE)发生进一步细胞分化和空间分隔的过程。该过程对后续组织/器官形成有重要影响,但其形成及调控机制是长期困扰学界的难题。近日,北京航空航天大学、中国科学院力学研究所、中国科学院动物研究所、北京化工大学、清华大学等联合团队研究了力学振荡机制在第二次细胞命运决定中的重要作用,揭示了囊胚腔的周期性振荡驱动其中上皮细胞(EPI)和原始内胚层细胞(PrE)空间分隔的机理及力学调控机制。该成果以“Cavity oscillation drives pattern formation in early mammalian embryos”为题发表于Cell Reports (2025, 44, 115342)。
科研团队注意到胚胎早期发育中产生的振荡机制,通过一系列创新实验方法,深入探究了囊胚腔振荡对胚胎模式形成的影响。通过生物和力学(AFM操控囊胚腔振荡)实验技术相结合,发现强化或抑制腔振荡会相应的加速或延迟EPI和PrE两种细胞的空间分离(图1)。进而,研究揭示了囊胚腔振荡促进细胞分离的生物力学机理。囊胚腔的物理振荡促进了ICM细胞间的接触波动和汇聚流动,有助于促进相互黏附作用差别较大的两种细胞的分离。通过数值模拟和实验验证相结合的方法,进一步证实了囊胚腔振荡在驱动胚胎模式形成中的核心作用(图2)。上述力学机理得到了基因表达结果的支持,共同揭示了生命体发育早期确保细胞分离和胚胎模式形成的一种强鲁棒性机制(图3)。该结果为理解早期哺乳动物胚胎发育中的模式形成机制提供了新的视角,也为未来研究胚胎发育中的物理和生物力学因素开辟了新的方向。
北京航空航天大学郭铮博士、姚杰教授,力学所郑旭副研究员为共同第一作者;北京航空航天大学樊瑜波教授和杜婧教授为共同通讯作者;力学所李航宇博士、关东石研究员在AFM压力及振荡调控实验方面,李龙副研究员在胚胎压力测量中做出了重要贡献。本研究得到了国家自然科学基金项目和中国科学院先导专项(XDB0620102)的支持。
论文链接:https://doi.org/10.1016/j.celrep.2025.115342
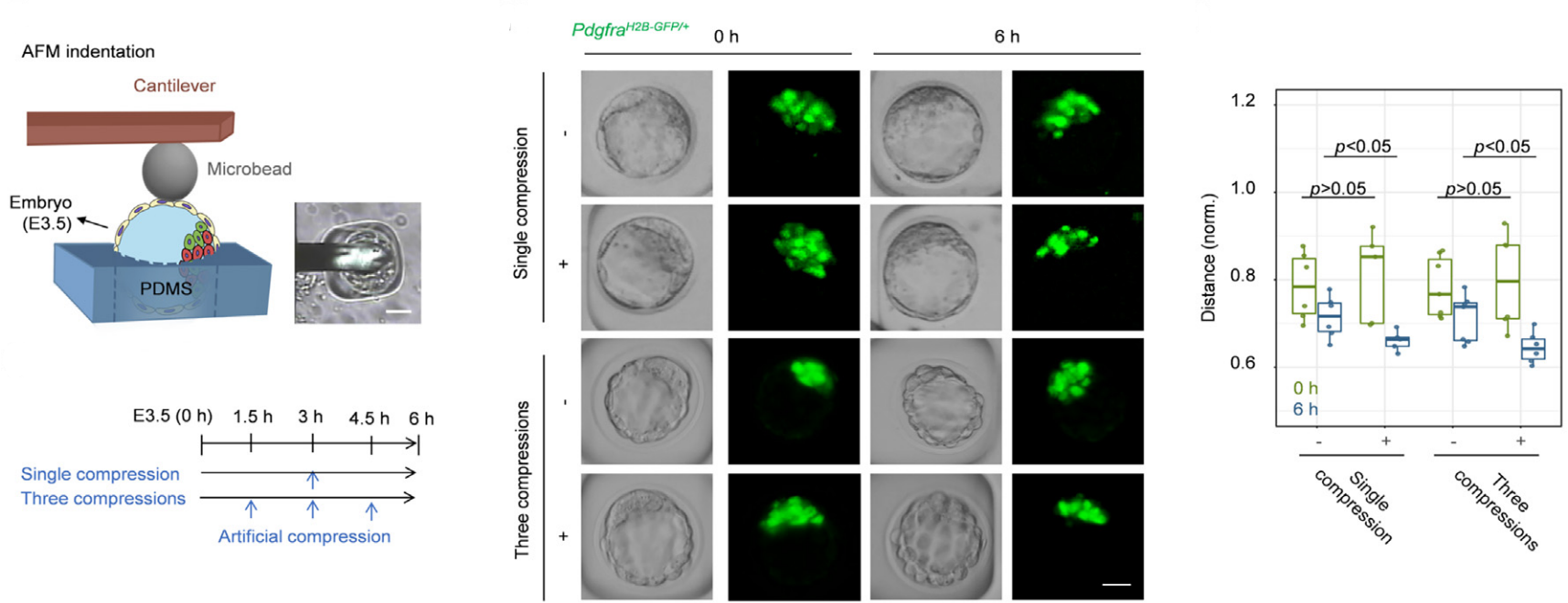
图1.通过AFM操控囊胚腔振荡的力学实验技术,发现强化或抑制腔振荡会相应的加速或延迟EPI和PrE两种细胞的空间分离
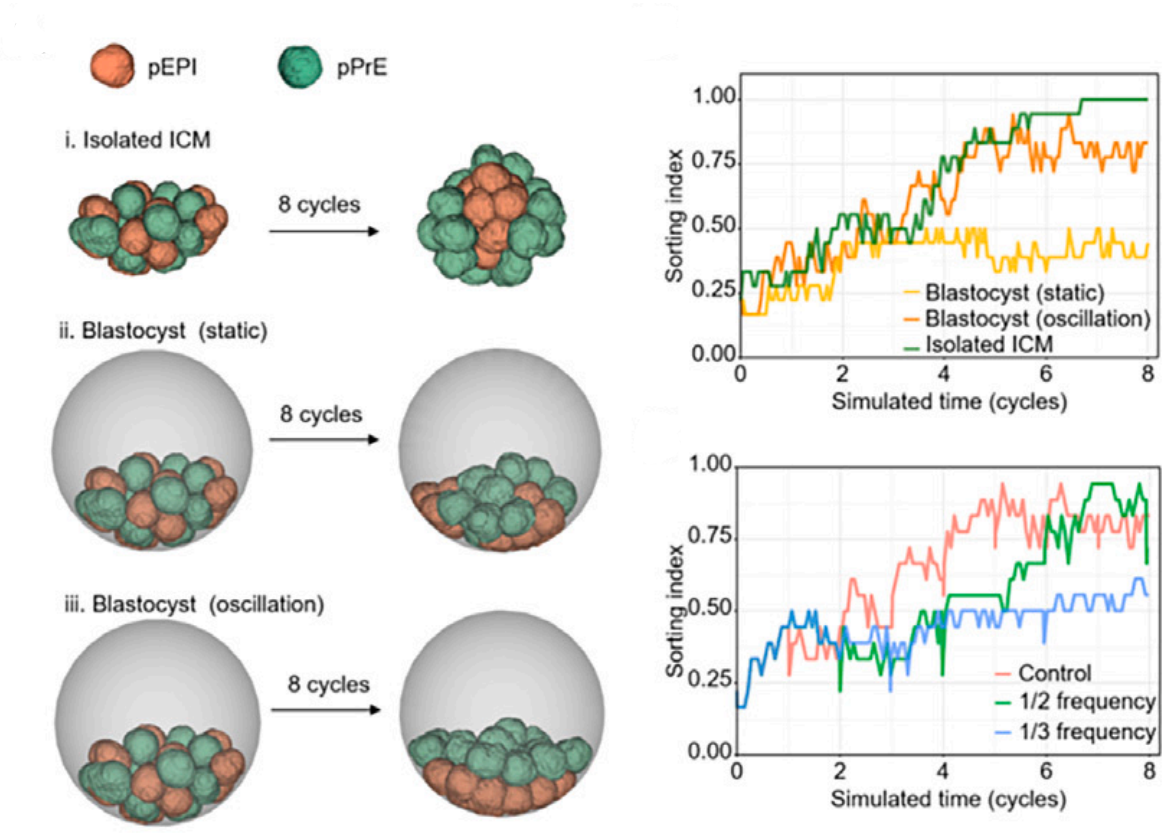
图2. 数值模拟显示囊胚腔的物理振荡促进了ICM细胞间的接触波动和汇聚流动
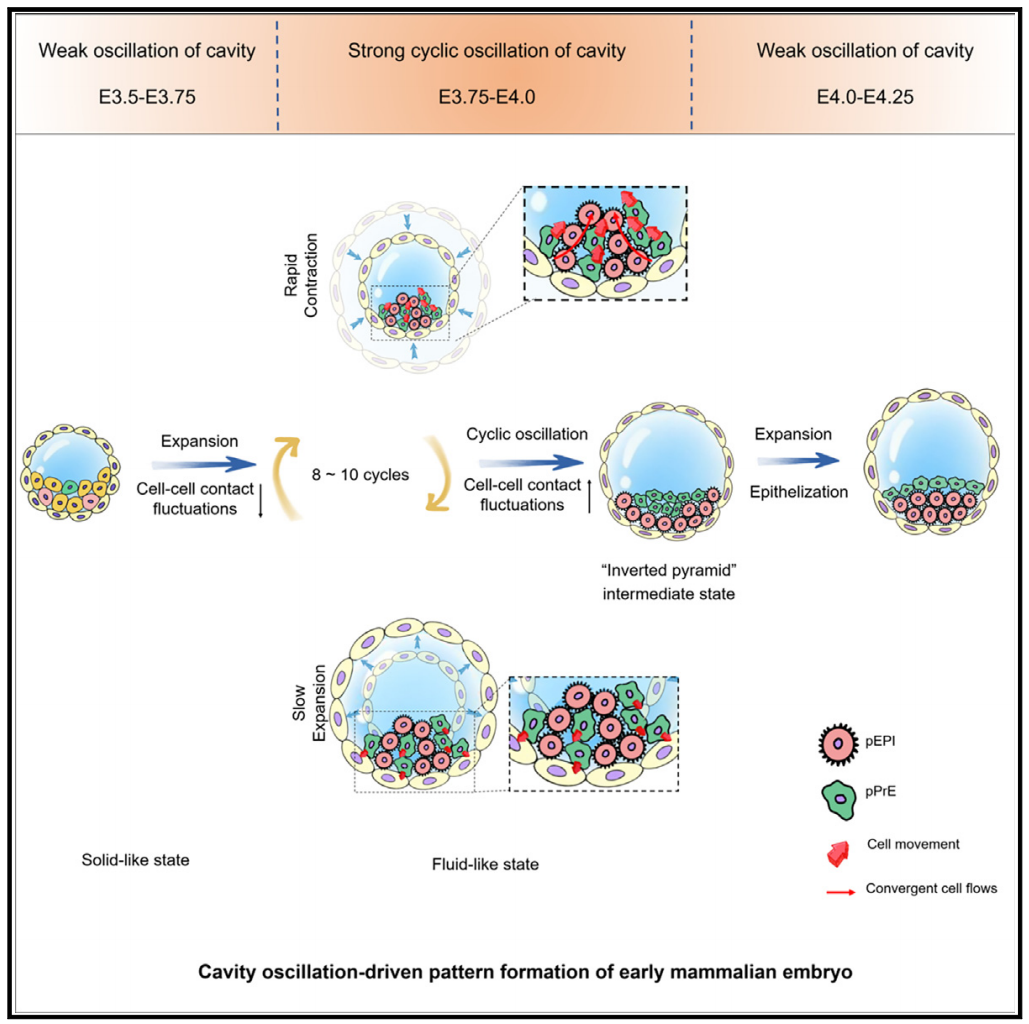
图3. 本研究揭示了生命体发育早期确保细胞分离和胚胎模式形成的一种强鲁棒性机制
附件下载: