

力学所在水凝胶粘弹性的时空调控与癌细胞迁移机制方面取得进展
癌细胞在迁移和转移过程中,如何感知并响应细胞外基质(ECM)的时空力学特性变化,一直是癌症生物学研究的关键问题。然而,现有技术难以实现对ECM粘弹性的动态调控,且紫外光调控存在细胞毒性等局限。近日,中国科学院力学研究所关东石研究员团队与上海科技大学郑宜君教授团队合作,成功开发了一种基于可见光响应的双动态交联水凝胶体系,首次实现了对水凝胶粘弹性的高精度时空调控,并揭示了癌细胞在动态力学环境中的“机械记忆”行为。该成果为癌症转移机制研究和靶向治疗提供了新工具,相关成果以“Visible light-responsive hydrogels for cellular dynamics and spatiotemporal viscoelastic regulation”为题发表于《Nature Communications》。
细胞外基质的粘弹性特性(即材料兼具流体的粘性和固体的弹性)显著影响癌细胞的扩散、迁移和转移。传统水凝胶虽能模拟生物组织的力学特性,但难以动态调控其粘弹性响应。研究团队通过分子设计创新,将贡献被动的粘弹性动态亚胺键与贡献可见光响应的动态二硫键(TDS)同时引入材料设计,构建了具有双重调控机制的水凝胶(图1)。在时间调控上,通过445 nm可见光照射,TDS基团触发二硫键交换反应,使应力松弛时间缩短至初始值的一半,且过程可逆、无细胞毒性。通过被动、主动调控相结合实现应力松弛的特征时间从100秒至3400秒的宽范围调节。在空间调控上,通过光刻技术,在亚细胞尺度(10 μm分辨率)构建粘弹性梯度(图2)。原子力显微镜(AFM)证实,光照区域应力松弛速率显著提高,而弹性模量保持不变,首次实现力学特性与化学组成的解耦调控。该水凝胶体系进一步应用于癌细胞迁移机制的研究(图3),发现了卵巢癌细胞(Hey)对力学信号的非线性响应以及对力学刺激具有时间依赖性记忆。该时空粘弹性水凝胶体系未来可进一步用于模拟肿瘤微环境力学异质性,优化抗转移药物,以及设计动态力学支架,引导组织修复等力学-生命科学前沿交叉领域。
该工作得到国家自然科学基金、国家重点研发计划、中国科学院战略性先导科技专项等资助。
论文链接:
https://doi.org/10.1038/s41467-024-54880-0
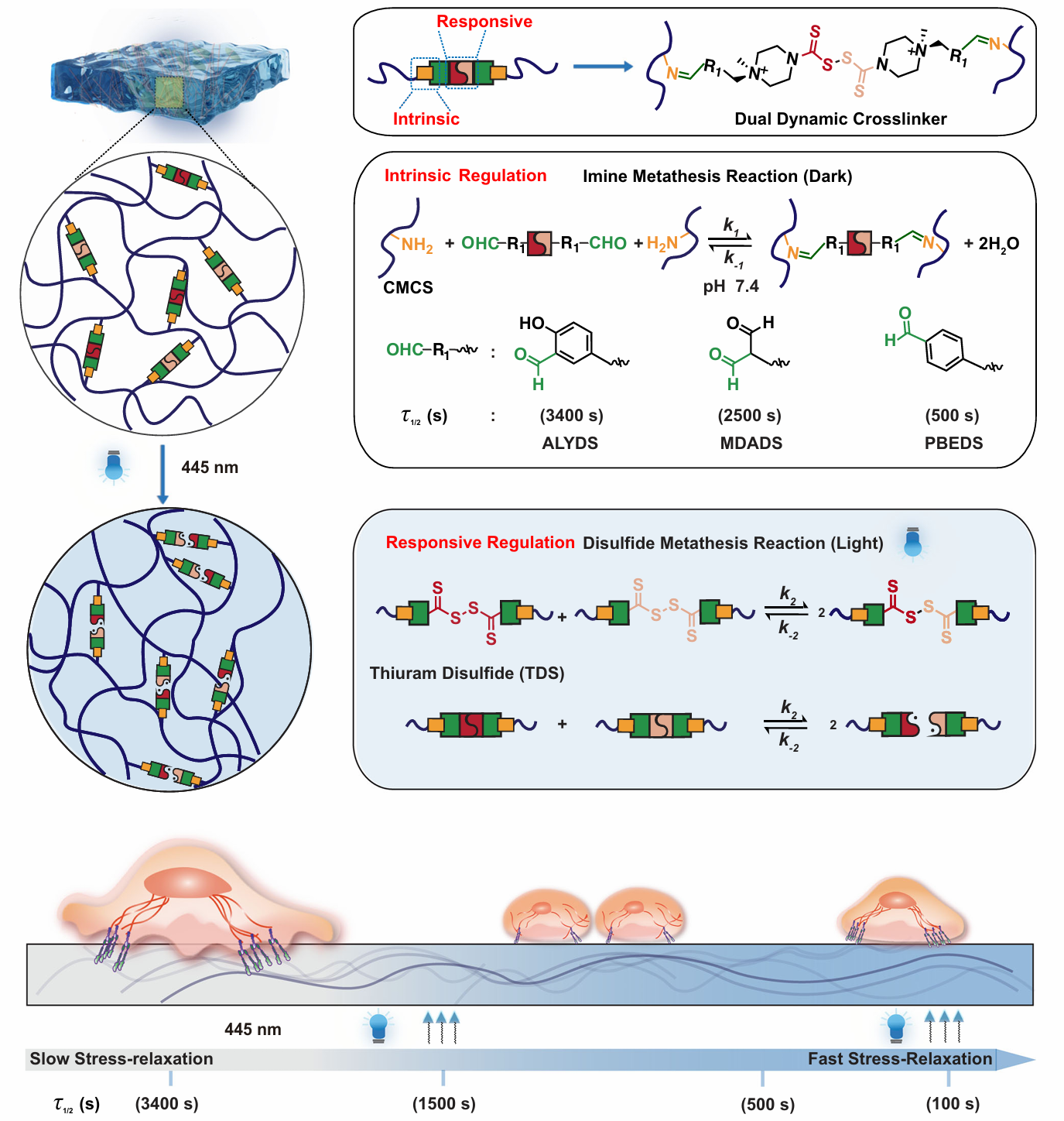
图1 具有可见光响应动态粘弹性水凝胶的设计和制备
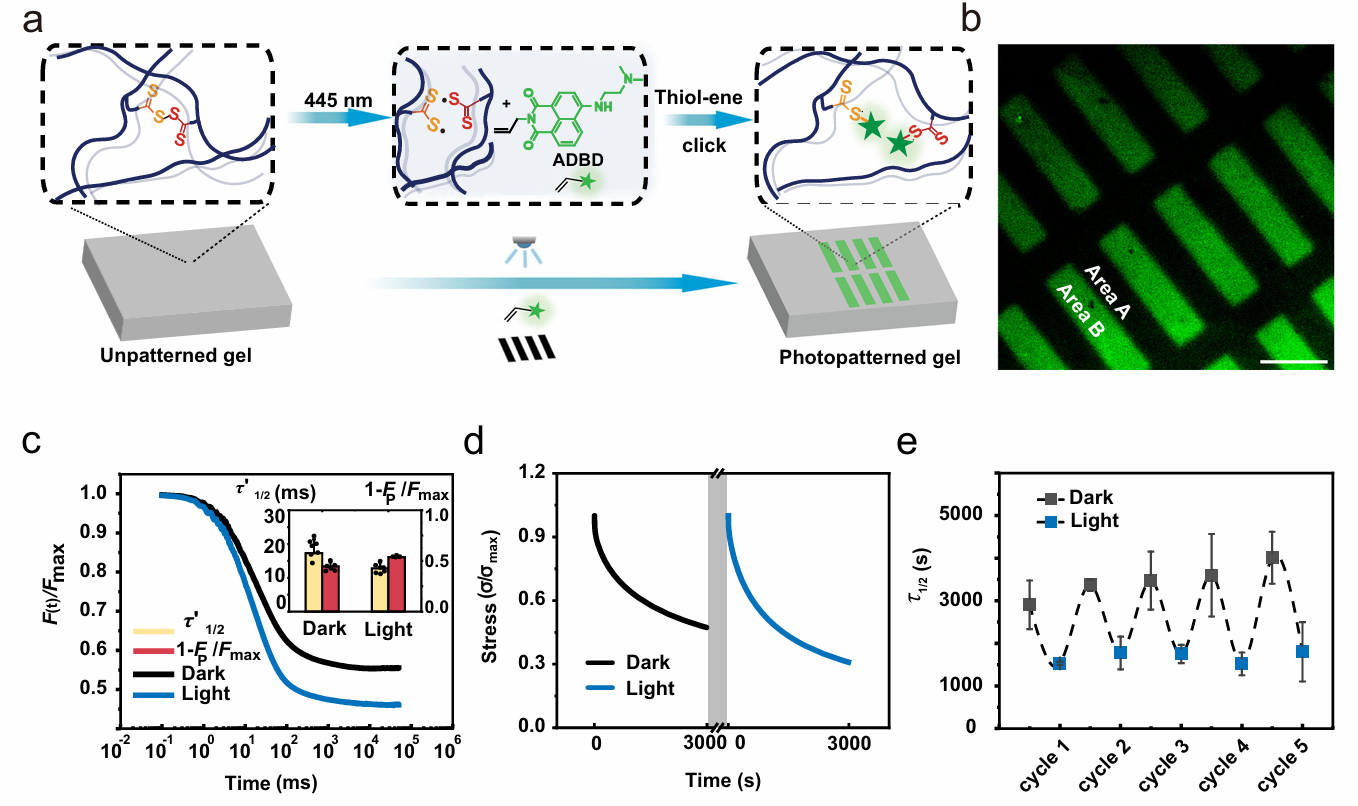
图2 水凝胶的高时空分辨光图案的制备和微小尺度粘弹性表征
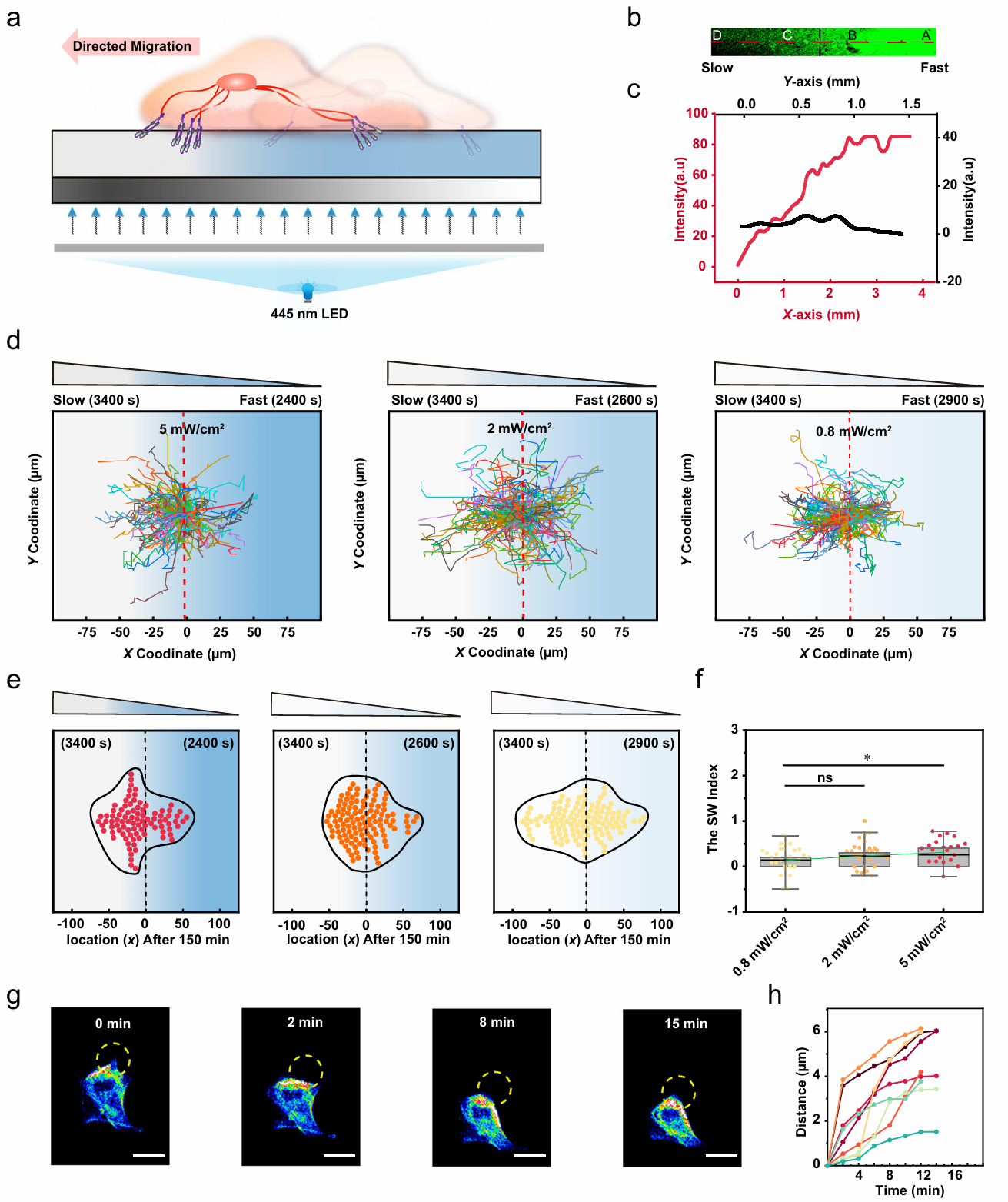
图3 空间尺度上的粘弹性梯度调控细胞迁移的方向
附件下载: